科技部長期深耕基礎研究,除追求學術卓越外,更希望將研究成果應用於人類福祉之改進,造福社會人群。本次成果即是在科技部「臺灣腦科技發展及國際躍升計畫」的支持下,由台大醫工系兼醫材中心主任王兆麟教授、中研院生醫所陳志成副所長、台大醫院復健科陳文翔主任、台大醫院神經外科賴達明主任共同組成跨校、跨領域的研究團隊,探索微能量超音波在腦中風所引起之血管性失智症治療之可能性。最新的發現已被國際重量級期刊eLife[1]接受發表,團隊中的臨床醫師也正積極評估運用目前研究成果於血管性失智症之治療。
腦中風所引起之失能與失智症常成為沉重照顧負擔
腦中風是造成死亡與重大急症的主因之一,在國人十大死因統計中,僅次於癌症、心臟疾病與肺炎,每年有超過一萬二千人(108年)因腦中風而死亡。雖然腦中風因醫療照護的進步,死亡率大幅下降,但所引發的血管性失智症成為國人失能的重要原因之一,日後之中、長期的醫療支出與家庭照顧成本,常成為沉重負擔。
微能量超音波刺激可調控神經細胞
王兆麟教授所率領的研究團隊針對此議題進行研究,探索創新之治療方法,獲得突破性成果。研究團隊開發出微針式超音波刺激儀(圖一上),可透過比細胞還小的玻璃針尖發射超音波,刺激神經細胞。團隊在中研院陳志成老師的指導下,使用此裝置激發神經細胞內的鈣離子,並與組織離體與小鼠活體實驗相互驗證,發現超音波可透過神經細胞膜上的ASIC1a離子通道,調控細胞內的鈣離子濃度(圖一下) ,並進而影響細胞內的生物訊號傳遞。
微能量超音波刺激可產生治療血管性失智症所需要的神經修復
為了測試此技術之臨床應用價值,臨床研究團隊發現經過多次超音波刺激後的小鼠大腦齒狀廻,有許多帶有雙皮質素的神經細胞(圖二)。雙皮質素的呈現是神經再生的指標。經由超音波刺激所產生的神經再生現象,有機會用於治療血管性失智症所需要的神經修復。本研究之發現奠定了超音波刺激對神經細胞進行調控的分子生物機制的了解,同時也提供了未來超音波治療血管性失智症之劑量調整與理論依據。
1. ASIC1a is required for neuronal activation via low-intensity ultrasound stimulation in mouse brain, Jormay Lin, .., Chih-Cheng Chen, Jaw-Lin Wang, eLife, 2021;10:e61660. DOI: 10.7554/eLife.61660
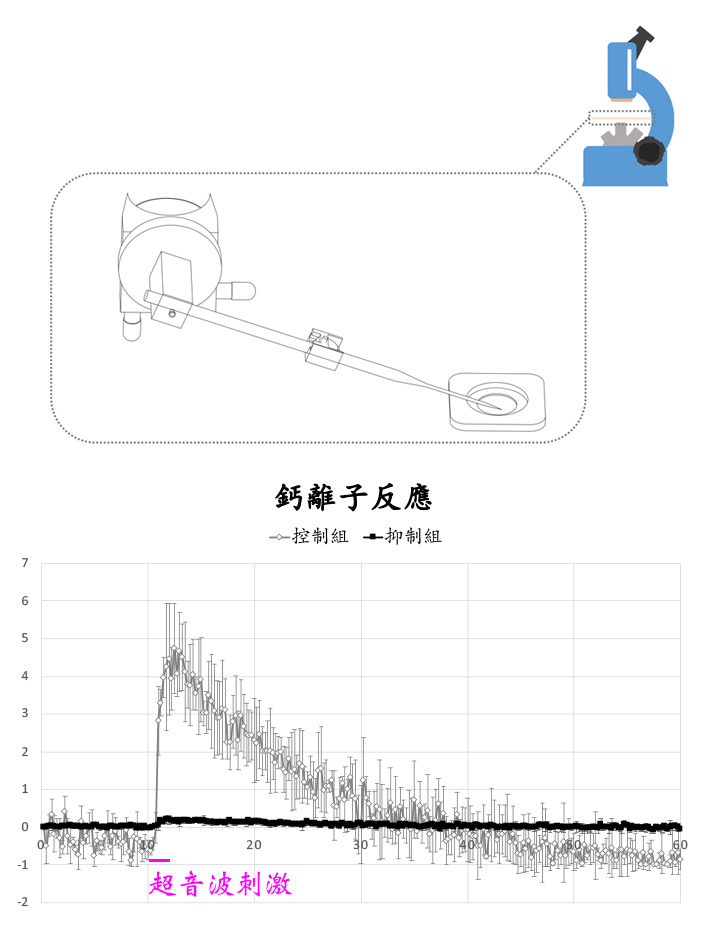
圖一
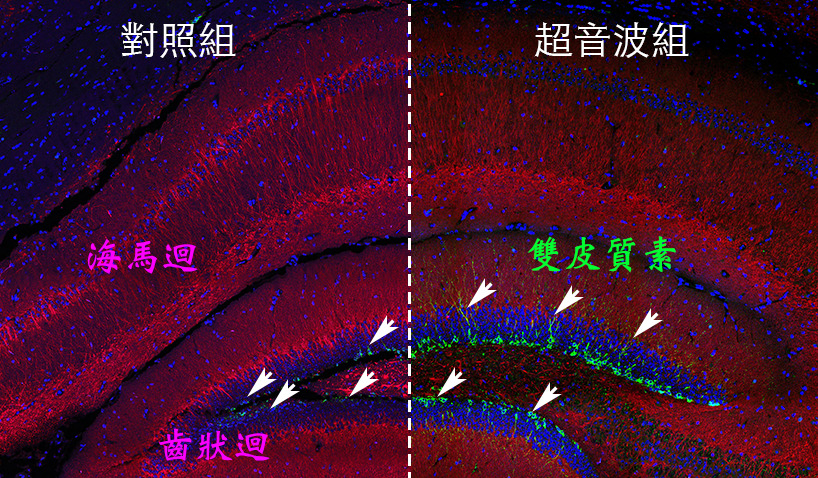
圖二

於科技部記者會合照,左起賴達明醫師、陳文翔醫師、科技部陳鴻震次長、王兆麟教授、中央研究院陳志成副所長
目前醫療界已開始注意到超音波對神經調節的作用,並開始嘗試用於腦部疾病的治療。但是對於超音波的生物物理機轉還不是很清楚,也因此限制了超音波的應用。為了瞭解超音波刺激如何影響細胞的分子機轉,我們研發了一套可精確控制的微能量超音波(VLIUS)系統,該系統的優點是可排除超音波的熱效應或空蝕效應。經由這套系統,我們發現了VLIUS的確可以影響細胞-細胞間與細胞-基質間的黏著,並可激發細胞骨架中有關黏著的分子開關。因此,我們將嘗試使用這套設備來刺激腦細胞與鼠腦,評估VLIUS是否可以用來治療腦血管疾病。總計畫將與工業界合作開發VLIUS設備以便提供給所有的子計畫使用,並與法國腦科學跨學科研究所(Interdisciplinary Institute for Neuroscience, IINS)展開跨國合作。子計畫一將觀察VLIUS對腦部內多種細胞的機械傳導反應,子計畫二則觀察VLIUS刺激下的神經軸突生長與突觸成形,子計畫三則研究VLIUS刺激對人工3D中樞神經組織之影響,這三項子計畫將釐清VLIUS刺激對腦細胞影響的生物理論基礎。同時,我們亦分別以動物模型探討VLIUS刺激對缺血性中風(子計畫四)和血管性失智(子計畫五)是否有正面影響。藉由檢驗VLIUS對細胞、組織和動物層級的影響,我們希望研發出一使用超音波治療缺血性中風和血管性失智方法。
老年肌少症造成行動問題,增加惡病質及疾病死亡率。而肌肉細胞或衛星細胞的老化及成肌作用降低被認為是老化肌少症的主要原因。已知超聲波藉由機械訊息傳導及MEK/ERK等路徑可使軟骨或腦組織增生修護; 由於無侵犯性,安全且易操作成為相當有潛力的醫療方式。在與台大醫工王兆麟教授合作下,本計畫初步結果顯示,因自由基壓力或老化生態位而老化的人類成肌細胞(HSMM)中,低頻間歇超聲波(LIPUS)可減少老化相關的細胞週期停滯蛋白如p16/p21的表現,增加細胞生長,並降低老化相關β半乳糖苷酶的活性及老化相關分泌型態(SASP)的分泌。但因細胞株有異質性且易老化,故(1)本計畫首先將分離初代肌肉衛星細胞,以更多的細胞老化模式來驗證LIPUS對降低幹細胞老化的效力;(2)本計畫也會檢測在三種不同的肌肉老化動物模式中,LIPUS降低動物體內肌肉細胞老化的效力。由於使用LIPUS後存在的老化細胞依然會造成老化生態位,為了達到更好的抗老化效果;(3)計畫進一步藉由LIPUS結合帶有促細胞凋亡BH3模擬物的脂質體,專一性的消除老化細胞以增加肌肉再生能力。超聲波除了可修護細胞,也可促進藥物分子脂質體的傳送效果,應用於有筋肌膜包覆的肌肉細胞是很理想的治療方式。此計畫提出新的肌少症處理策略且易被施行,極有臨床應用的潛力。
聽力損傷在成年人中,是僅次心血管病與風濕病的第三大疾病種類。全球約有四億六千萬聽力損傷患者,聽力損傷所造成的經濟與社會損失非常龐大。聽損病人中約90%屬於感覺神經性聽損,目前聽覺退化的治療方式仍以外部的助聽器和人工耳蝸植入為主,尚未有其他能用於修復受損耳蝸的醫療方式。本計畫的目的是探索利用微能量超音波治療神經性聽損的可能性。我們發現超音波可以調控上皮細胞和神經細胞,而內毛細胞和外毛細胞無論在結構或功能上都與上皮細胞和神經細胞都有相似之處,因此我們認為超音波或許有可能可以影響或修復耳蝸細胞。本計畫若能成功,將有可能可以發展出一套使用超音波治療感覺神經性聽損的方法。
Neurodegeneration is one of the major risk factors leading to neural diseases, disables, and chronic pain in modern aging societies and causes huge societal losses. In this study, we propose an innovative idea in regenerating neurons for potential treatment of neurodegenerative diseases via piezoelectricity. We hypothesized that properties of piezoelectricity can be used for the neuromodulation to promote nerve regeneration. Although piezoelectricity is widely observed in human bodies, the biological effect of this property on living tissue is, however, not clear yet. Prof Chen at AS IBMS found the advillin, an actin-binding protein, in dorsal root ganglion (DRG) neurons affects growth cone reach out and hence may play an important role in axon regeneration, and Prof Wang at NTU BME found that chondrogenesis of mesenchymal stem cells (MSC) and DRG neurons reactive to piezoelectric stimulation. With these two findings, we aim to find the effect of piezoelectric stimulation on neural modulation and axon regeneration via the correspondent regulation on neuron advillin. To limit the scope of this study, we will focus on the effect of piezoelectric stimulation on DRG neurons as the first step. The finding of this study will provide us the scientific basis for future design of implantable piezoelectric biomaterials and/or ex vivo stimulation devices for the treatment of neurodegenerative diseases.
椎間盤退化是常見的脊椎退化疾病,所花費的醫療與社會成本也相當的高。椎間盤在退化初期並沒有有效的治療或預防方法,大部分的病人只能在退化晚期使用高風險與昂貴的手術方式治療。臨床上,低能量超音波生物刺激已用於加快骨癒合速度,很多的基礎研究也發現低能量超音波生物刺激有助於增進細胞的生物活性。本實驗室的前導實驗亦發現極低能量超音波(VLIUS)確能影響椎間核(NP)細胞的生物行為。因此,本計畫將測試超音波是否能促進椎間核細胞之生物活性,並評估是否有可能成為治療或預防椎間盤退化的方法。一個有效的治療方法必須包含三個要素,第一:有明確的醫療效益;第二:其醫療效益之生物機轉必須是清楚的;第三:治療的劑量反應(dose response)關係必須能量化,因此才能設計出治療的劑量。有鑑於此, 必須了解低能量超音波對椎間核細胞的生物物理機轉,以及相對應的劑量反應,將來才有可能設計出適當醫療劑量。由於椎間核細胞是生長在靜水壓力(Hydrostatic Pressure, HP)環境,而一般的細胞培養環境都沒有外在壓力,為了模擬活體環境,以及上述臨床情境要求,本實驗設計了兩個實驗目標,分別是了解靜水壓力和超音波對以下 5 個生物活性的影響:1 細胞形態、2 細胞機械信號轉導、3 細胞骨架動力學、4 細胞外基質(ECM)之 mRNA、以及 5 細胞外基質合成。為了能控制與觀察這些變因與變數,本計畫特別設計了一可施加靜水壓力與超音波能量,並可長時間觀察活體細胞的顯微鏡載台。此外,為了能有效量化觀察變數,我們也將設計一微構模型(micropattern),增加實驗的精度。我們希望藉由本計畫的完成,可了解超音波對於椎間核細胞之生物物理機轉,並進而研發出可有效治療或預防椎間盤退化的方法。
「經皮脊骨整型術」(Percutaneous Vertebroplasty, PVP)是對於骨鬆椎骨之壓迫性骨折(Osteoporotic Vertebral Compression Fracture,OVCF)有良好效果的積極性療法,醫師主要利用動態X光顯像(Fluoroscopy)及電腦斷層影像導引(CT Image Guidance)來協助其施打骨水泥至骨折位置。然而X光顯像較無法精確判讀,發生手術併發症的機率較高,醫師亦須接收輻射線劑量成為職業風險。CT影像導引的方式則因電腦斷層掃瞄儀已逐漸成為國內各醫院的標準配備而逐漸普及,醫師也可避免接收輻射,臨床上即發展出CT影像導航系統協助手術。市面上導航系統的器械皆須特製,以供系統追蹤同時進行巡航診斷及導引手術,設計上為可重複使用。而這提高了滅菌不完全可能導致之感染風險,也造成器械笨重而影響醫師手術習慣及手感。本計畫考量此情境,欲開發一套更加融入PVP手術流程的「脊椎穿刺雷射導引系統」,預期利用雷射投射元件同步巡航診斷探針方位,將手術路徑以雷射光擴增至患者實境以協助導引穿刺,避免了前述器械使用疑慮。此創新概念改善了醫學導航系統手術的安全性,預期技轉至合作公司執行商品化,發展成具臨床使用性產品。計畫執行過程中將協助合作公司擴展臨床工程合作管道。另外本單位研究助理人員與參與研究學生亦可在參與過程中提升醫療及工程的轉譯能力,培育政府長遠規劃的產業人才。